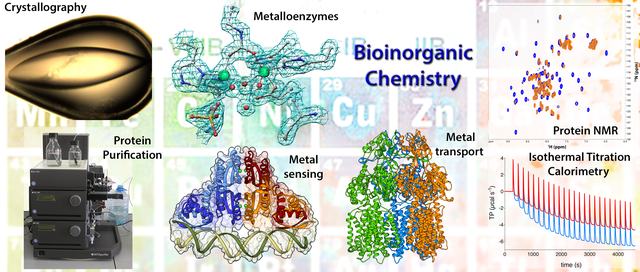
Fig. 1: Esempi di proteine studiate nel Laboratorio di Chimica Bioinorganica e alcune delle tecniche impiegate.
Temi di ricerca del gruppo
Le proteine studiate sono isolate con tecniche di biologia molecolare, e la loro struttura è determinata utilizzando la spettroscopia NMR e la biocristallografia in modo complementare e sinergico con la spettroscopia di raggi X, il biomodeling, la chimica computazionale, la spettroscopia di fluorescenza, il light scattering (dinamico e multi-angolo) e la microcalorimetria.
I temi di ricerca attualmente in corso sono i seguenti:
- Lo studio della struttura e della chimica dell'ureasi, un enzima contenente nichel, che catalizza l'idrolisi dell'urea a dare ioni ammonio e bicarbonato nell'ultimo stadio della biomineralizzazione dell'azoto organico. Inibitori dell'ureasi possono aumentare l'efficienza della fertilizzazione azotata con urea e diminuire gli effetti negativi delle infezioni dell'apparato gastrointestinale e urinario da parte di batteri patogeni ureolitici. La progettazione di inibitori efficienti, ed aventi minimo impatto ambientale e umano, necessita della struttura molecolare del sito attivo per lo structure-based molecular design.
- Lo studio delle proteine accessorie dell’ureasi necessarie per il trasporto del nichel (UreE) e per l'assemblaggio in vivo del sito metallico (UreD, UreF, UreG) dell’ureasi è un tema importante del nostro gruppo, in quanto rappresenta una nuova possibilità di identificare nuovi possibili targets per il drug design. L’identificazione della struttura di queste proteine e delle loro interazioni, in presenza e in assenza di nichel e cofattori, è necessaria per comprendere il loro meccanismo di funzionamento e quindi come sia possibile modularlo ed eventualmente inibirlo con molecole dedicate.
- L’omeoastasi del nichel nei batteri è studiata a livello trascrizionale, attraverso la determinazione della relazione struttura-funzione di regolatori trascrizionali metallo dipendenti (NikR, RcnR, SrnR) e di trasportatori di membrana di ioni nichel (NixA).
- Il nichel è un carcinogeno di classe 1 a livello nasale e polmonare ed è un importante inquinante ambientale, presente in quantità significative nelle polveri sottili derivanti dall’inquinamento atmosferico. I meccanismi molecolare alla base della sua carcinogenicità sono ancora sconosciuti. Attraverso lo studio di proteine che legano nichel e che sono coinvolte nello sviluppo del tumore al polmone cerchiamo di comprendere come il nichel agisce a livello cellulare per indurre la trasformazione delle cellule. Questa comprensione è importante per disegnare molecole che agiscano per prevenire o curare questo tipo di tumore.
- Studi sulle relazioni struttura - funzione di proteasi virali da SARS-CoV-2, Dengue virus e West Nile virus. La tematica di ricerca consiste nello svolgimento di studi strutturali e cinetici dell’attività delle proteasi virali e della loro inibizione, al fine di individuare nuove molecole come potenziali farmaci. La ricerca è svolta in collaborazione con scienziati del Rensselaer Polytecnical Institute (Troy, NY, USA).
- Infine, recentemente è stato inaugurato un filone di ricerca dedicato allo studio della relazione struttura-funzione di varianti patogene di proteine cruciali per la respirazione cellulare, come il complesso I e il complesso III.
Per ulteriori informazioni, visita il nostro sito web.

