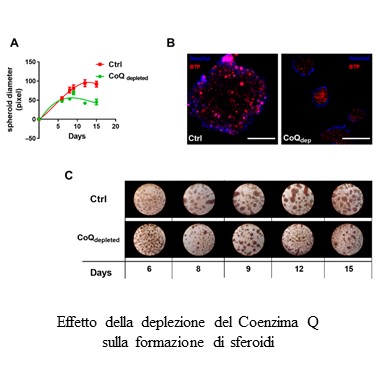
Temi di ricerca del gruppo
Il termine “cancro” è indicativo di una serie di stati patologici che hanno in comune il fatto di indurre profonde trasformazioni nelle cellule, caratterizzate da alterazioni genetiche, istologiche e bioenergetiche associate a una incontrollata proliferazione cellulare, un’elevata resistenza all’apoptosi e a notevoli modificazioni metaboliche. La “riprogrammazione” metabolica delle cellule tumorali è uno stadio cruciale nella trasformazione neoplastica ed è strettamente correlata con il grado di invasività del tumore. La modificazione metabolica più comune, osservata nelle cellule tumorali, è rappresentata dal maggiore consumo di glucosio tramite la glicolisi aerobica, che comporta un’aumentata produzione di acido lattico. In origine, l’aumento della glicolisi in cellule tumorali in condizioni aerobiche, è stato descritto da Otto Warburg e tuttora è noto come “effetto Warburg”. Inizialmente questo particolare fenotipo bioenergetico è stato spiegato ipotizzando un danno mitocondriale. Studi recenti hanno dimostrato che nelle cellule tumorali la catena respiratoria mitocondriale non è danneggiata, anche se funziona a velocità ridotta e ciò permette alle cellule tumorali di spostare facilmente il loro metabolismo da un fenotipo glicolitico ad un fenotipo ossidativo e viceversa, in relazione alle risorse presenti nel microambiente tumorale.
L’effetto Warburg è, quindi, solo una parte di un fenomeno molto complesso di riprogrammazione metabolica che permette alle cellule di adattarsi alle modificazioni del microambiente ed in particolare all’acidosi e alla diminuzione della disponibilità di substrati e di ossigeno, che si verificano quando la massa tumorale cresce. I vantaggi specifici di queste modificazioni metaboliche non sono ancora del tutto chiari, tuttavia ci sono evidenze sperimentali che dimostrano che la down-regolazione del metabolismo ossidativo possa aumentare la capacità delle cellule di sfuggire alla morte per apoptosi. Un’altra caratteristica delle cellule tumorali è l’invasività, strettamente correlata alla malignità del tumore e alla sua capacità di dare metastasi. Alcuni autori hanno messo in evidenza il rapporto esistente tra fenotipo metabolico glicolitico e invasività del tumore.
L’attività di ricerca del gruppo si articola su tre linee principali: